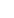登录 |
注册 |
 购物车 |
帮助中心 |
English Vision
购物车 |
帮助中心 |
English Vision
 022-58105045
022-58105045
技术与支持
SUPPORT
流式凋亡实验你做对了吗
细胞凋亡(apoptosis)指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。细胞凋亡与细胞坏死不同,细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等的作用,它并不是病理条件下,自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。
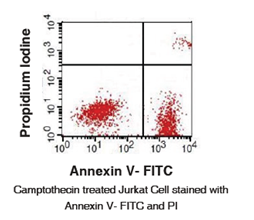
检测凋亡的方法很多,其中磷脂酰丝氨酸外翻分析法是最常用的一种方法。其原理是:磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin-V是一种Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素标记,以标记了荧光素nexin-V作为探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核染色。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
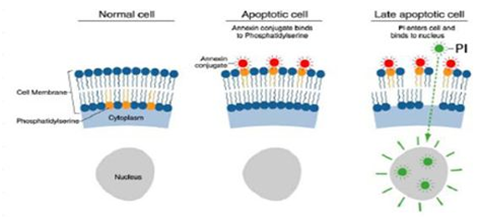
我们公司在Annexin-V/PI试剂盒的基础上进行了产品升级,加入了凋亡阳性诱导剂,主要是为了方便客户调节补偿。当检测细胞凋亡的时候,如果发生凋亡的细胞较少,那么没有明显的阳性群,我们调节补偿的时候会比较困难。如果补偿调节不当,将影响后续数据的分析。而阳性诱导剂的使用则避免了以上的情况。
下面对我们试剂盒的使用方法(以Annexin V-FITC/PI试剂盒为例)进行一下介绍:
单染管处理:
1,取1×106 -3×106个细胞(实验中未做任何处理的细胞),将细胞平均分到两支流式管中,加入4ml 1X PBS,对细胞进行清洗,300×g/分钟,离心10分钟,去上清。
2,其中一管加入200ul 1X binding buffer,保存在4℃备用。
3,另一支流式管中加入500ul 阳性诱导剂,室温放置10分钟。加入3ml 1X PBS,300×g/分钟,离心10分钟,去上清。再加入4 ml 1X PBS,300×g/分钟,离心10分钟,去上清。剩余细胞加入200ul 1X binding buffer重悬。
4,将两支流式管细胞混合,然后分到3个流式管中,每管100ul。
5,第一支管为空白对照,第二支管加入5ul Annexin V-FITC,第三支管加入5ul PI,将流式管置于室温,避光染色5分钟。
6,加入300-500ul PBS,混匀上机,调节仪器电压和补偿。
【注意:以上单染管只用于仪器调节补偿,实验组细胞不得使用阳性诱导剂处理】
实验组细胞染色:
1,使用1×105 ~1X106个细胞,加入4ml 1X PBS,对细胞进行清洗,300×g/分钟,离心10分钟,去上清。
2,加入 100ul 1X binding buffer重悬细胞。
3,加入5ul Annexin V-FITC与细胞中,混匀,室温避光染色10分钟。
4,再加入5ul PI,混匀,室温避光染色5分钟。
5,加入300-500ul PBS,混匀上机。
【注意:上机实验应在染色后1小时内完成】
上一章:流式抗体选购原则
下一章:流式常见问题解析(一)荧光素的选择发布时间: 2017-12-15